Tabel Periodik Unsur Kimia – Hello para pembaca dosenpintar.com, kali ini kita akan membahas mengenai tabel periodik unsur kimia. Yuk simak langsung mengenai tabel periodik unsur kimia beserta ulasan lengkapnya di bawah ini.
Pengertian Tabel Periodik Unsur Kimia
Tabel periodik unsur kimia merupakan tampilan unsur-unsur kimia yang ditampilkan dalam bentuk tabel. Pada dasarnya unsur kimia tersebut diurutkan berdasarkan susunan nomor atom (jumlah proton dalam inti atom), konfigurasi elektron, dan keberulangan sifat kimia. Tabel juga terbagi menjadi empat blok yaitu blok -s, -p, -d, dan -f. Pada umumnya, dalam satu periode (baris), di sebelah kiri bersifat logam, dan di sebelah kanan bersifat non-logam, tabel sistem periodik unsur kimia ini pun menjadi salah satu materi pelajaran penting yang harus dipahami.
Kolom pada tabel disebut golongan, sedangkan baris pada tabel disebut periode. Enam golongan (kolom) memiliki nama selain nomor, contoh: unsur golongan 17 adalah halogen, dan golongan 18 adalah gas mulia. Pada umumnya Tabel periodik digunakan untuk menurunkan hubungan antara sifat-sifat unsur, dan memperkirakan sifat unsur baru yang belum ditemukan atau disintesis. Sering sekali digunakan untuk melakukan analisi perilaku kimia, selain dalam bidang ilmu kimia, tabel periodik juga diperlukan dalam ilmu lainnya.
Tabel Periodik
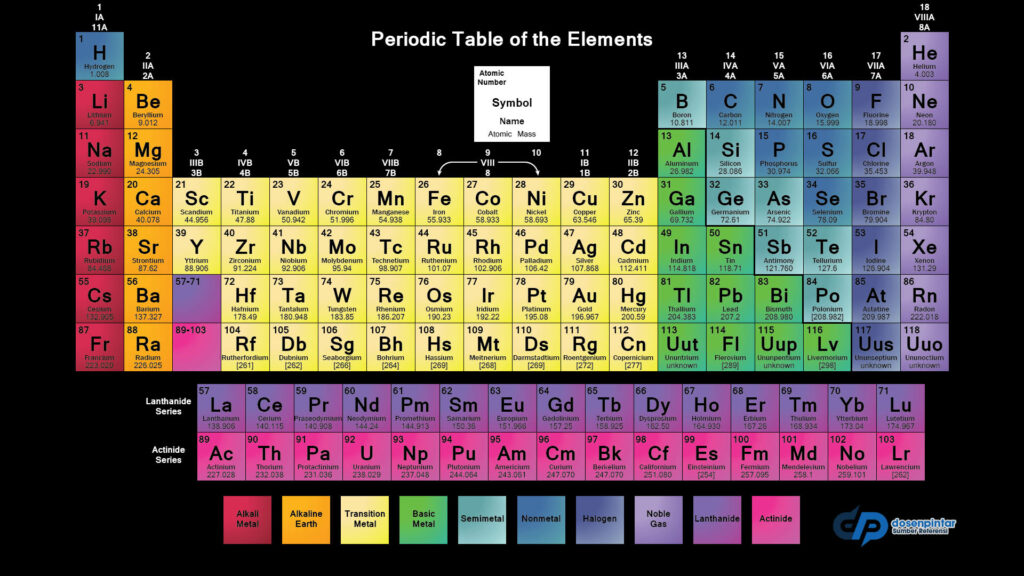
Keterangan :
| No Atom | Unsur Kimia | Simbol |
| 1 | hidrogen | H |
| 2 | helium | He |
| 3 | lithium | Li |
| 4 | beryllium | Be |
| 5 | boron | B |
| 6 | carbon | C |
| 7 | nitrogen | N |
| 8 | oxygen | O |
| 9 | fluorine | F |
| 10 | neon | Ne |
| 11 | sodium | Na |
| 12 | magnesium | Mg |
| 13 | aluminium | Al |
| 14 | silicon | Si |
| 15 | phosporus | P |
| 16 | sulfur | S |
| 17 | chlorine | Cl |
| 18 | argon | Ar |
| 19 | pottasium | K |
| 20 | calcium | Ca |
| 21 | scandium | Sc |
| 22 | titanium | Ti |
| 23 | vanadium | V |
| 24 | chronium | Cr |
| 25 | manganese | Mn |
| 26 | iron | Fe |
| 27 | cobalt | Co |
| 28 | nickle | Ni |
| 29 | copper | Cu |
| 30 | zinc | Zn |
| 31 | gallium | Ga |
| 32 | germanium | Ge |
| 33 | arsenic | As |
| 34 | selenium | Se |
| 35 | bromine | Br |
| 36 | krypton | Kr |
| 37 | rubidium | Rb |
| 38 | stronium | Sr |
| 39 | yttrium | Y |
| 40 | zirconium | Zr |
| 41 | niobium | Nb |
| 42 | molybdenum | Mo |
| 43 | technetium | Tc |
| 44 | rutheium | Ru |
| 45 | rhodium | Rh |
| 46 | palladium | Pd |
| 47 | silver | Ag |
| 48 | cadmium | Cd |
| 49 | indium | In |
| 50 | tin | Sn |
| 51 | anitomy | Sb |
| 52 | tellurium | Te |
| 53 | iodine | I |
| 54 | xenon | Xe |
| 55 | cesium | Cs |
| 56 | barium | Ba |
| 57 | lanthanum | La |
| 58 | cerium | Ce |
| 59 | praseodymium | Pr |
| 60 | neodymium | Nd |
| 61 | promethium | Pm |
| 62 | samarium | Sm |
| 63 | europium | Eu |
| 64 | gadolinium | Gd |
| 65 | terbium | Tb |
| 66 | dysprosium | Dy |
| 67 | holmium | Ho |
| 68 | erbium | Er |
| 69 | thulium | Tm |
| 70 | ytterbium | Yb |
| 71 | lutetium | Lu |
| 72 | hafnium | Hf |
| 73 | tantalum | Ta |
| 74 | tungsten | W |
| 75 | rhenium | Re |
| 76 | osmium | Os |
| 77 | iridium | Ir |
| 78 | platinum | Pt |
| 79 | gold | Au |
| 80 | mercury | Hd |
| 81 | thallium | Tl |
| 82 | lead | Pb |
| 83 | bismuth | Bi |
| 84 | polonium | Po |
| 85 | astatine | At |
| 86 | radon | Rn |
| 87 | francium | Fr |
| 88 | radium | Ra |
| 89 | actinium | Ac |
| 90 | thorium | Th |
| 91 | protactinum | Pa |
| 92 | uranium | U |
| 93 | neptunium | Np |
| 94 | plutonium | Pu |
| 95 | americium | Am |
| 96 | curium | Cm |
| 97 | barkelium | Bk |
| 98 | californium | Cf |
| 99 | einstenium | Es |
| 100 | fermium | Fm |
| 101 | mendelevium | Md |
| 102 | nobelium | No |
| 103 | lawrencium | Lr |
| 104 | rutherfordium | Rf |
| 105 | dubnium | Db |
| 106 | seaborgium | Sg |
| 107 | bohrium | Bh |
| 108 | hassium | Hs |
| 109 | meitnerium | Mt |
| 110 | darmstadtium | Ds |
| 111 | roentgenium | Rg |
| 112 | copernicum | Cn |
| 113 | ununtrium | Uut |
| 114 | unuquadium | Uuq |
| 115 | ununpentium | Uup |
| 116 | unuhexium | Uuh |
| 117 | ununseptium | Uus |
| 118 | ununoctium | Uuo |
Cara Membaca Tabel Priodik Unsur Kimia
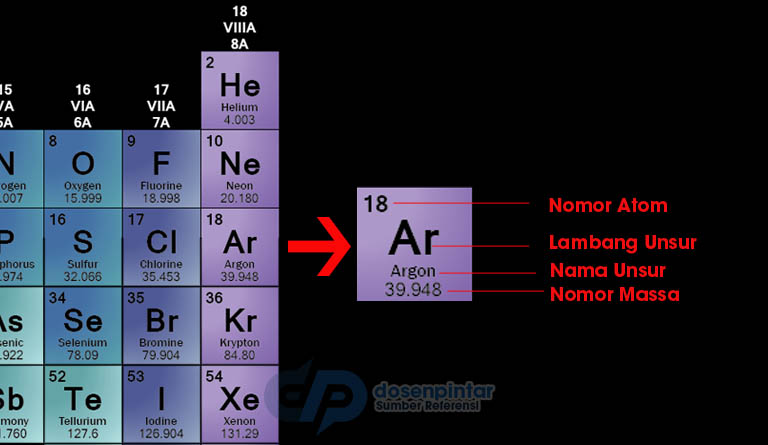
Penjelasan dari gambar di atas adalah bahwa Ar adalah simbol dari elemen Arogon (Anda dapat melihat pada tabel deskripsi yang telah dijelaskan di atas), dan elemen tersebut memiliki nomor atom 18 dan nomor massa adalah 39.948
Unsur Unsur Table Periodik
- Gol IA (logam alkali)
Untuk kelompok IA, semua logam adalah logam lunak yang sekeras penghapus karet dan dapat diiris dengan pisau dan memiliki kepadatan li, Na dan K, semuanya kurang dari 1 g / cm3. - Gol IIA (Logam Logam Logam)
Logam alkali tanah atau dalam IIA diklasifikasikan sebagai logam aktif, tetapi reaktifitasnya kurang dibandingkan dengan logam alkali seperti titik, dan akan terbakar di udara hanya ketika dipanaskan, dengan pengecualian bérélium karena alkali logam tanah hanya larut dalam air. Dan digunakan sebagai obat untuk kesehatan maag. - Gol VIIA (halogen)
Kelas VIIA adalah sekelompok elemen non-logam yang sangat reaktif. Karena terikat pada elektron valensinya, yang setara dengan 7, hanya dibutuhkan satu elektron ekstra untuk mendapatkan konfigurasi yang stabil seperti pada contoh gas langka. - Gol VIIIA (gas mulia)
Kemudian, unsur-unsur kelas VIIIA, yaitu helium, neon, argon, krypton, xenon dan sangat sulit bereaksi dengan unsur lain. Dan di dalam, kita bahkan tidak menemukan senyawa alami dari unsur-unsurnya. - Gol B (elemen transisi)
Kemudian, unsur-unsur transisi adalah unsur-unsur di tengah sistem unsur periodik, yaitu unsur-unsur kelompok tambahan (kelompok B).
Demikianlah artikel mengenai tabel periodik unsur kimia. Semoga artikel ini bisa menambah wawasan bagi pembaca dosenpintar.com dan sampai kertemu lagi di artikel lainnya.
Baca Juga :
- √ 5 Sifat Periodik Unsur Beserta Pengertiannya
- √ Contoh Konfigurasi Elekttron Beserta Pengertiannya
- √ Perkembangan Sistem Periodik Unsur : Sifat logan Non Logam
Source: https://dosenpintar.com/tabel-periodik-unsur-kimia/
Posted by: ardithreaue078190.blogspot.com
